Содержание
- 2. Русецкая О.П. Электролитическая диссоциация
- 3. Русецкая О.П. 1 1. Рис.1 Электролиты Неэлектролиты
- 4. «Капля воды и камень точит» 1. Электролиты и неэлектролиты Вода – хороший растворитель, т.к. молекулы воды
- 5. Русецкая О.П. 1. Электролиты и неэлектролиты это вещества, растворы и расплавы которых проводят электрический ток. Электролиты
- 6. + + + + - - - - Анионы Катионы Анод Катод - + Русецкая О.П.
- 7. Русецкая О.П. 1. Электролиты и неэлектролиты это вещества, растворы или расплавы которых не проводят электрический ток.
- 8. Анод Катод - + Русецкая О.П. Рис.3. Неэлектролиты
- 9. «Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов 2.Электролитическая диссоциация процесс распада молекул электролита
- 10. «Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов 2.Электролитическая диссоциация Аррениус Сванте Август Шведский
- 11. + + - - + + - - Раствор Кристалл - + + + - -
- 12. Раствор НCl → Н+ + Cl - Механизм электролитической диссоциации веществ с ковалентной полярной связью Н2О
- 13. 2.Сильные и слабые электролиты HCl + + + Сильные и слабые Рис.6.
- 14. Русецкая О.П. отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе. Степень электролитической диссоциации
- 15. 2.Сильные и слабые электролиты Электролиты
- 16. 2.Сильные и слабые электролиты %
- 17. Русецкая О.П. это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются только
- 18. Русецкая О.П. это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только
- 19. Русецкая О.П. это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы кислотного
- 20. 6. О значении электролитов для живых организмов Электролитическая диссоциация Электролиты – составная часть жидкостей и плотных
- 21. 6. Рис.8. Характерные симптомы дефицита химических элементов в организме человека подробнее
- 22. Ошибка Молодец Молодец Ошибка Молодец Молодец Сильные электролиты Ca(OH)2 Электролиты Неэлектролиты 7.Проверка знаний Выберите указанные понятия
- 23. Русецкая О.П. Электролитическая диссоциация 7. Проверка знаний Русецкая О.П. Электролитическая диссоциация в растворах – это процесс
- 24. Механизм электролитической диссоциации NaCl Разрушение кристаллической решетки под действием молекул воды. Гидратация NaCl + nН2О →Na+
- 26. Скачать презентацию























 Неорганические основания
Неорганические основания Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола
Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола Общая характеристика элементов VII группы главной подгруппы. Хлор
Общая характеристика элементов VII группы главной подгруппы. Хлор Диеновые углеводороды
Диеновые углеводороды Презентация на тему Эфиры, жиры
Презентация на тему Эфиры, жиры  Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева Модульная технология на уроках химии
Модульная технология на уроках химии Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи
Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи Первое положение теории А.М. Бутлерова Атомы в молекулах органических веществ соединяются последовательно
Первое положение теории А.М. Бутлерова Атомы в молекулах органических веществ соединяются последовательно Гальванический элемент
Гальванический элемент Техника безопасности на уроках химии
Техника безопасности на уроках химии Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Производство уранового топлива. Обогащение урана
Производство уранового топлива. Обогащение урана Валентность, классы и номенклатура неорганических веществ
Валентность, классы и номенклатура неорганических веществ Путешествие в мир кислот
Путешествие в мир кислот Вольтамперометрия. Полярография постоянного тока. Лекция 3 (ФХМА)
Вольтамперометрия. Полярография постоянного тока. Лекция 3 (ФХМА) Процесс фильтрации - задержание твердых взвешенных частиц
Процесс фильтрации - задержание твердых взвешенных частиц Презентация на тему Строение Бензола
Презентация на тему Строение Бензола  Химия. Подготовка к контрольной работе
Химия. Подготовка к контрольной работе Алкены. Строение. Изомерия. Химические свойства. Получение
Алкены. Строение. Изомерия. Химические свойства. Получение Химия переходных элементов. Триада железа и металлы платиновой группы
Химия переходных элементов. Триада железа и металлы платиновой группы Металловедение
Металловедение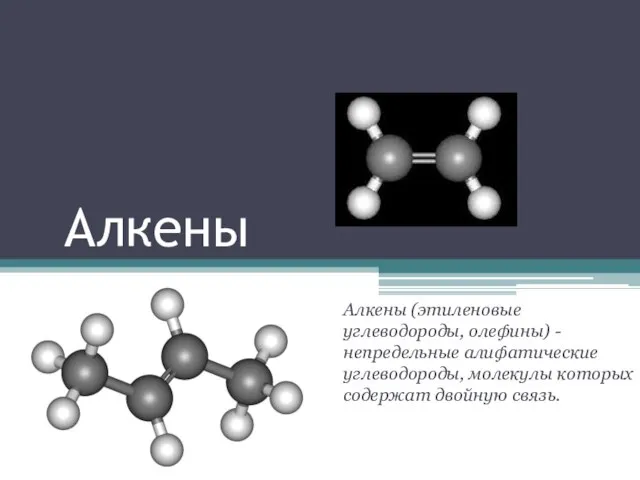 Алкены
Алкены Общая характеристика неметаллов
Общая характеристика неметаллов Презентация на тему Основные классы неорганических соединений
Презентация на тему Основные классы неорганических соединений  Типы химических реакций
Типы химических реакций Галогеноводородные кислоты
Галогеноводородные кислоты Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры
Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры