Содержание
- 2. ВЕЩЕСТВА Органические Углеводороды Кислородосодержащие Предельные Непредельные СПИРТЫ УГЛЕВОДЫ КАРБОНОВЫЕ КИСЛОТЫ АЛЬДЕГИДЫ ЭФИРЫ
- 3. СПИРТЫ - это органические вещества, в которых гидроксильная группа связана с углеводородным радикалом. Соответствующие общей формуле
- 4. СН3ОН метанол (метиловый спирт) С2Н5ОН этанол (этиловый спирт) количество гидроксильных групп глицерин Этиленгликоль(антифриз)
- 6. ФИЗИЧЕСКИЕ СВОЙСТВА Низшие спирты (С1-C11)-летучие жидкости с резким запахом Высшие спирты (C12-…)- твердые вещества с приятным
- 8. ФИЗИЧЕСКИЕ СВОЙСТВА Низшие спирты (С1-C11)-летучие жидкости с резким запахом Высшие спирты (C12-…)- твердые вещества с приятным
- 9. Применение
- 10. Получение этанола 1. Гидратация этилена: СН2 = СН2 + Н2О → С2Н5ОН этилен этанол 2. Брожение
- 11. Химические свойства спиртов 1. Горение 2СН3ОН + 3О2→ 2СО2 + 4Н2О метанол Горит бесцветным пламенем. С2Н5ОН
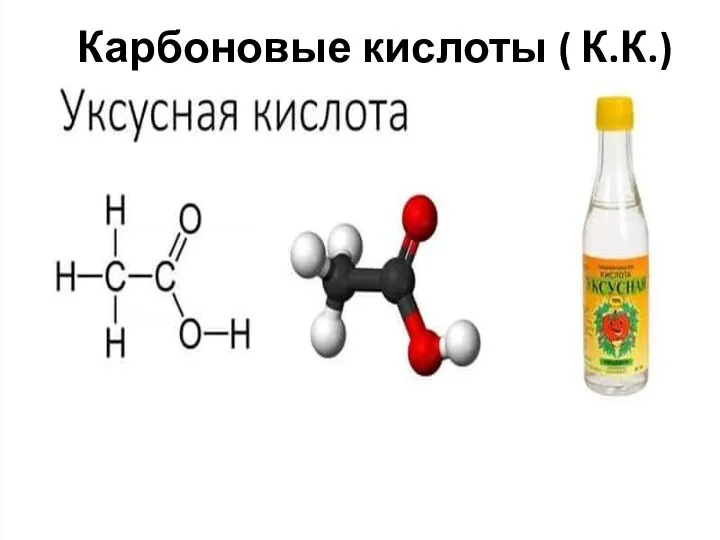
- 12. Карбоновые кислоты ( К.К.)
- 13. ХИМИЧЕСКИЕ СВОЙСТВА 1.Диссоциация СН3СООН ⇄ СН3СОО- + Н+ ацетат Изменяет окраску индикатора: свою окраску не меняет
- 14. Х.С. 2. Взаимодействует с металлами: 2СН3СООН + Мg → (CH3COO)2Mg + H2 ацетат магния 3. Взаимодействует
- 16. Скачать презентацию












 Витамины. Классификация витаминов
Витамины. Классификация витаминов Основания. Получение оснований
Основания. Получение оснований Минерал Александрит
Минерал Александрит Химические вещества
Химические вещества Оксиды и гидроксиды металлов
Оксиды и гидроксиды металлов Разбор заданий
Разбор заданий Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Классификация органических веществ
Классификация органических веществ Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Самостоятельная работа
Самостоятельная работа Разминка
Разминка Окислители в пиросоставах
Окислители в пиросоставах Алканы и алкены
Алканы и алкены Синтетические волокна
Синтетические волокна Органическая химия. Подготовка к экзамену
Органическая химия. Подготовка к экзамену Čo sú chemické reakcie
Čo sú chemické reakcie Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Проточные реакторы непрерывного действия. (Лекция 5)
Проточные реакторы непрерывного действия. (Лекция 5) Презентация на тему Что такое белки?
Презентация на тему Что такое белки?  Понятие о химической реакции. Реакции, идущие без изменения состава веществ
Понятие о химической реакции. Реакции, идущие без изменения состава веществ Решение расчетных задач по уравнениям реакций
Решение расчетных задач по уравнениям реакций Жидкое состояние вещества
Жидкое состояние вещества Кислоты. Номенклатура. Классификация
Кислоты. Номенклатура. Классификация Химическое расследование. Химические свойства галогенов
Химическое расследование. Химические свойства галогенов Алкины
Алкины Водород. Свойства, применение
Водород. Свойства, применение obschaya_kharakteristika_prostykh_alifaticheskikh_efirov
obschaya_kharakteristika_prostykh_alifaticheskikh_efirov Презентация на тему Железо
Презентация на тему Железо